????? 2024年,國家藥監(jiān)局以習近平新時代中國特色社會主義思想為指導�����,全面貫徹黨的二十大和二十屆二中��、三中全會精神�,按照“講政治�、強監(jiān)管、保安全����、促發(fā)展��、惠民生”的工作思路�����,全面深化醫(yī)療器械審評審批制度改革�,健全支持醫(yī)療器械創(chuàng)新發(fā)展機制,強化醫(yī)療器械注冊質(zhì)量管理����,夯實醫(yī)療器械監(jiān)管基礎(chǔ),加強監(jiān)管能力建設�����,推動產(chǎn)業(yè)創(chuàng)新高質(zhì)量發(fā)展。
??一��、醫(yī)療器械注冊工作情況
??(一)醫(yī)療器械監(jiān)管法治建設穩(wěn)步推進���。2024年�����,國家藥監(jiān)局通過深入調(diào)研論證����,廣泛征求意見�����,完成《醫(yī)療器械管理法(草案送審稿)》�,將為加快推進我國從制械大國向制械強國跨越提供更加堅實的法治保障。印發(fā)《醫(yī)療器械臨床試驗機構(gòu)監(jiān)督檢查辦法(試行)》及機構(gòu)檢查要點和判定原則�����,強化臨床試驗規(guī)范化管理���。會同國家衛(wèi)生健康委發(fā)布《醫(yī)療機構(gòu)臨床急需醫(yī)療器械臨時進口使用管理要求》���,進一步滿足特殊情況下臨床診療救治急需�。研究修訂《醫(yī)療器械臨床試驗項目檢查要點和判定原則》��,強化臨床試驗項目管理���。研究修訂《關(guān)于進口醫(yī)療器械產(chǎn)品在中國境內(nèi)企業(yè)生產(chǎn)有關(guān)事項的公告》���,進一步鼓勵跨國企業(yè)在中國境內(nèi)生產(chǎn)。
??(二)創(chuàng)新醫(yī)療器械獲批數(shù)量持續(xù)增長��。2024年����,國家藥監(jiān)局共批準創(chuàng)新醫(yī)療器械65個�����,優(yōu)先審批醫(yī)療器械8個�,創(chuàng)新醫(yī)療器械批準數(shù)量連續(xù)兩年維持高位,獲批產(chǎn)品的質(zhì)量和數(shù)量取得雙豐收����。支氣管導航控制系統(tǒng)��、體外心室輔助設備�、腎動脈射頻消融儀等多款高端醫(yī)療器械上市���,覆蓋手術(shù)機器人��、心肺支持輔助系統(tǒng)�、人工智能等多領(lǐng)域���。其中����,心臟內(nèi)超聲成像系統(tǒng)����、融合超聲和光聲成像技術(shù)的雙模態(tài)超聲成像產(chǎn)品、基于多病種算法設計的眼底圖像輔助診斷軟件���、小型化集成型單室質(zhì)子治療系統(tǒng)等產(chǎn)品在國內(nèi)首次獲批����,不僅為患者提供了更多治療選擇,還有效提升了臨床手術(shù)的安全性和成功率����,更好地滿足人民群眾使用高水平、高質(zhì)量醫(yī)療器械的需求�。選取醫(yī)用機器人、人工智能醫(yī)療器械���、高端醫(yī)學影像設備和新型生物材料4個重點領(lǐng)域��,研究全鏈條集成創(chuàng)新支持政策�����。3個猴痘病毒檢測試劑獲準注冊����,全力服務保障重大公共衛(wèi)生需求�。成立高端醫(yī)療裝備創(chuàng)新合作平臺����,匯聚政產(chǎn)學研醫(yī)各領(lǐng)域優(yōu)勢資源,加強顛覆性�����、原創(chuàng)性技術(shù)研究和科技成果轉(zhuǎn)化。推進第一批人工智能醫(yī)療器械創(chuàng)新任務�、生物醫(yī)用材料創(chuàng)新任務揭榜掛帥工作,確定106個人工智能醫(yī)療器械優(yōu)勝項目�����。
??(三)國家重大區(qū)域戰(zhàn)略穩(wěn)步落實�。大力支持粵港澳大灣區(qū)、海南自貿(mào)港�、福建等重點區(qū)域建設。批準人工耳蝸聲音處理器等3個海南臨床真實世界應用試點產(chǎn)品上市����,截至2024年底,累計批準產(chǎn)品12個���,惠及更多患者�。指導粵港澳大灣區(qū)使用48種��、158批次港澳已上市的醫(yī)療器械����,服務區(qū)域診療需要���。批復福建省局對臺灣地區(qū)產(chǎn)第一類醫(yī)療器械實施備案,支持福建探索海峽兩岸融合發(fā)展新路���。指導出臺《北京市促進臨床急需藥械臨時進口工作實施方案》《粵港澳大灣區(qū)內(nèi)地九市進口港澳藥品醫(yī)療器械管理條例》�,規(guī)范區(qū)域內(nèi)臨床急需醫(yī)療器械管理����。
??(四)醫(yī)療器械注冊備案管理不斷規(guī)范。開展“進省局��、進企業(yè)���、進醫(yī)院��,促創(chuàng)新���、促規(guī)范、促提升”的“三進三促”專題調(diào)研�����,以點帶面維護醫(yī)療器械注冊備案工作秩序��。組織召開醫(yī)療器械注冊管理片區(qū)工作座談會����,分析研討注冊管理工作面臨的形勢和挑戰(zhàn)。落實二類首個產(chǎn)品注冊管理機制�。召開第一類醫(yī)療器械備案管理工作現(xiàn)場會、第一類醫(yī)療器械備案工作聯(lián)系點座談會����,細化工作指導,督促建立完善備案管理工作機制�����。各級藥監(jiān)局對第二類醫(yī)療器械注冊信息和第一類產(chǎn)品備案信息實行月度�����、季度主動公開���,接受社會監(jiān)督���。
??(五)注冊管理風險防控機制逐步完善。每季度召開注冊備案問題風險會商會�����,會商研判管理類別或?qū)傩詥栴}、規(guī)范性問題�����。臨床試驗檢查力度持續(xù)加大����,截至2024年底,臨床試驗機構(gòu)備案共計1498個��。各省級藥品監(jiān)管部門共開展機構(gòu)檢查885家次����,比上年增加55.5%,占備案機構(gòu)數(shù)量的59.1%��。國家局分兩批對50個在審品種開展臨床試驗現(xiàn)場檢查和產(chǎn)品真實性核查�,檢查數(shù)量比2023年增加66%,有力發(fā)揮監(jiān)督抽查震懾作用�。
??(六)醫(yī)療器械審評審批能力加速提升。組織開展省級醫(yī)療器械審評人員和審評機構(gòu)能力評價��,推動醫(yī)療器械審評審批能力提升。舉辦醫(yī)療器械注冊法規(guī)與注冊管理實務培訓��、12期線上和6期線下第二類醫(yī)療器械審評實訓���、臨床試驗監(jiān)管和檢查人員專題培訓、體外診斷試劑分類網(wǎng)絡專題培訓等���,系統(tǒng)內(nèi)外累計培訓11300人次����。發(fā)揮官方網(wǎng)站和公眾號信息發(fā)布平臺作用��,持續(xù)更新“器審云課堂”�����,已收錄課程431個�����,不斷提升政務服務水平��。全年發(fā)布120項指導原則����。推進監(jiān)管科學行動計劃第三批重點項目���。
??(七)醫(yī)療器械標準體系建設不斷夯實。2024年�����,下達行業(yè)標準制修訂計劃項目100項�����,通過快速程序批準2項采用腦機接口技術(shù)的醫(yī)療器械相關(guān)行業(yè)標準立項����,鼓勵相關(guān)產(chǎn)品研發(fā)創(chuàng)新。批準發(fā)布醫(yī)療器械行業(yè)標準90項�。2024年獲批國家標準制修訂項目33項,發(fā)布醫(yī)療器械國家標準49項?��,F(xiàn)行有效醫(yī)療器械標準2023項(國家標準296項���、行業(yè)標準1727項)。統(tǒng)籌推進新版GB 9706系列標準實施��。深入?yún)⑴c國際標準化工作,《人工智能醫(yī)療器械 肺部影像輔助分析軟件 算法性能測試方法》等6項國際標準有序推進���,我國主導制定的ISO 7151:2024《外科器械 非切割鉸接器械通用要求和試驗方法》國際標準獲批發(fā)布����;新增國際標準化組織注冊專家144人���,1名中國標準化專家獲任ISO和IEC國際標準組織聯(lián)絡員,標準國際化進程穩(wěn)步推進���。
??(八)醫(yī)療器械分類管理進一步細化���。修訂發(fā)布《體外診斷試劑分類目錄》,設立一級產(chǎn)品類別25個��,二級產(chǎn)品類別1852個��,同步發(fā)布配套實施通告及解讀��,進一步強化體外診斷試劑分類指導�,支持體外診斷試劑創(chuàng)新發(fā)展。修訂發(fā)布《關(guān)于規(guī)范醫(yī)療器械產(chǎn)品分類界定工作的公告》���,優(yōu)化分類界定工作流程�,提升分類界定工作質(zhì)量和效率。針對近視控制�����、弱視治療類產(chǎn)品��、應用納米材料的醫(yī)療器械等熱點產(chǎn)品研究起草分類界定指導原則���,加強交叉管理產(chǎn)品研究���。啟動《醫(yī)療器械分類目錄》與通用名命名對應研究,推進銜接整合���。選取部分植入類醫(yī)療器械開展醫(yī)療器械通用名稱與醫(yī)保通用名關(guān)聯(lián)映射研究���,強化三醫(yī)聯(lián)動。
??(九)監(jiān)管科學研究深入推進���。組織推進新一代基因測序產(chǎn)品評價方法研究�、數(shù)字療法醫(yī)療器械質(zhì)量評價方法研究等9個醫(yī)療器械上市前重點項目45個子項目研究工作��,強化督促指導。加快推進全國藥品監(jiān)管科學重點實驗室建設�����,開展腦機接口系統(tǒng)柔性電極安全性評價等12項檢驗方法研究��。組織開展醫(yī)療器械企業(yè)合規(guī)能力建設探索研究��,引導企業(yè)構(gòu)建質(zhì)量合規(guī)體系����,探索建立醫(yī)療器械質(zhì)量合規(guī)管理能力評估機制以及評估結(jié)果應用的可行路徑�。
??(十)國際交流合作取得實質(zhì)性進展。著力推動GHWP發(fā)展���,積極履行主席義務�����,設立戰(zhàn)略咨詢委員會��、組建能力建設委員會��、成立審評互信實踐特別工作組�����,進一步增進組織活力��;已完成10項指南文件的制修訂���,為組織發(fā)展夯實支撐���;在廣州創(chuàng)立全球首家GHWP醫(yī)療器械培訓學院,加快提升成員國家和地區(qū)的監(jiān)管能力����。積極參加IMDRF,跟進國際醫(yī)療器械監(jiān)管最新進展����,部署新項目研究,加快國際規(guī)則轉(zhuǎn)化實施����。
??二、醫(yī)療器械注冊申請受理情況
2024年���,國家藥監(jiān)局依職責共受理醫(yī)療器械首次注冊��、延續(xù)注冊和變更注冊申請共計13828項��,與2023年相比增加4.3%�����。
??(一)整體情況
??受理境內(nèi)第三類醫(yī)療器械注冊申請7600項����,受理進口醫(yī)療器械注冊申請6228項。
??按注冊品種區(qū)分�����,醫(yī)療器械注冊申請10271項�����,體外診斷試劑注冊申請3557項����。
??按注冊形式區(qū)分�,首次注冊申請3678項,占全部醫(yī)療器械注冊申請的27%���;延續(xù)注冊申請4894項���,占全部醫(yī)療器械注冊申請的35%���;變更注冊申請5256項,占全部醫(yī)療器械注冊申請的38%�。注冊形式比例情況見圖1。
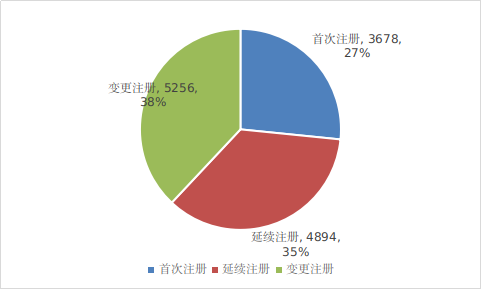
圖1 國家藥監(jiān)局注冊受理項目注冊形式比例圖
??(二)分項情況
??1.境內(nèi)第三類醫(yī)療器械注冊受理情況
??境內(nèi)第三類醫(yī)療器械注冊受理共7600項��,與2023年相比增加7%��。其中�,醫(yī)療器械注冊申請5877項,體外診斷試劑注冊申請1723項����。
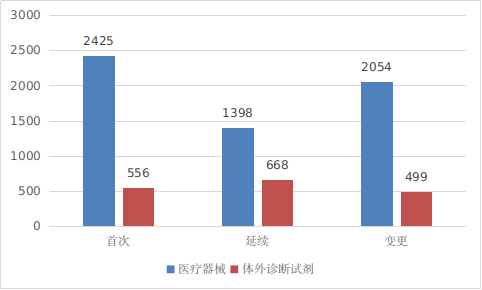
圖2 境內(nèi)第三類醫(yī)療器械注冊受理項目注冊形式分布圖
??從注冊形式看,首次注冊2981項���,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的39.2%��;延續(xù)注冊2066項���,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的27.2%����;變更注冊2553項�,占全部境內(nèi)第三類醫(yī)療器械注冊申請數(shù)量的33.6%。注冊形式分布情況見圖2�����。
??2.進口第二類醫(yī)療器械注冊受理情況
??進口第二類醫(yī)療器械注冊受理共3295項�,與2023年相比增加8.5%。其中醫(yī)療器械注冊申請1805項���,體外診斷試劑注冊申請1490項���。
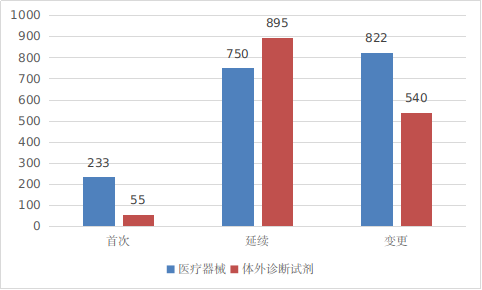
圖3 進口第二類醫(yī)療器械注冊受理項目注冊形式分布圖
??從注冊形式看,首次注冊288項�,占全部進口第二類醫(yī)療器械注冊申請數(shù)量的8.7%;延續(xù)注冊1645項����,占全部進口第二類醫(yī)療器械注冊申請數(shù)量的49.9%��;變更注冊1362項�,占全部進口第二類醫(yī)療器械注冊申請數(shù)量的41.4%�����。注冊形式分布情況見圖3��。
??3.進口第三類醫(yī)療器械注冊受理情況
??進口第三類醫(yī)療器械注冊受理共2933項�,與2023年相比減少5.9%���。其中醫(yī)療器械注冊申請2589項����,體外診斷試劑注冊申請344項���。
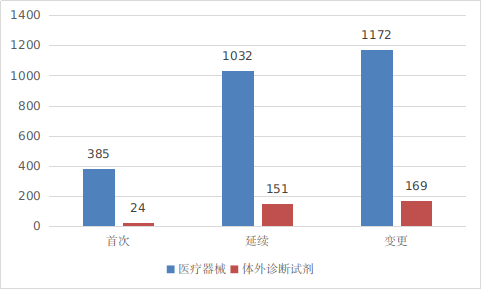
圖4 進口第三類醫(yī)療器械注冊受理項目注冊形式分布圖
??從注冊形式看�,首次注冊409項���,占全部進口第三類醫(yī)療器械注冊申請數(shù)量的14%����;延續(xù)注冊1183項��,占全部進口第三類醫(yī)療器械注冊申請數(shù)量的40.3%;變更注冊1341項�����,占全部進口第三類醫(yī)療器械注冊申請數(shù)量的45.7%����。注冊形式分布情況見圖4。
??三�、醫(yī)療器械注冊審批情況
??2024年,國家藥監(jiān)局共批準醫(yī)療器械首次注冊���、延續(xù)注冊和變更注冊13133項���,與2023年相比注冊批準總數(shù)量增長7.5%。
??其中��,首次注冊3363項�����,與2023年相比大幅增加23.3%���。延續(xù)注冊4722項�,與2023年相比減少1.4%���,連續(xù)三年減少���。變更注冊5048項,與2023年相比增加7.5%���。
??2024年�����,企業(yè)自行撤回首次注冊申請��、自行注銷注冊證書380項����。
??近11年國家藥監(jiān)局批準醫(yī)療器械注冊情況見圖5����。
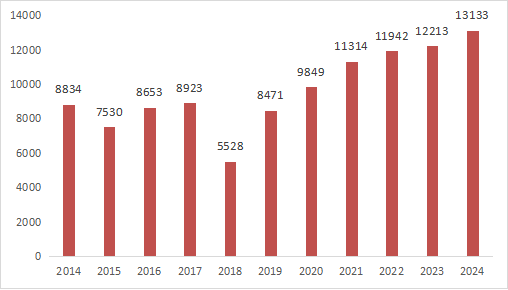
圖5? 國家藥監(jiān)局2014至2024年度注冊數(shù)據(jù)圖
??(一)整體情況
??2024年,國家藥監(jiān)局批準境內(nèi)第三類醫(yī)療器械注冊6886項���,與2023年相比增加11.9%����,進口醫(yī)療器械6247項,與2023年相比增加3.1%�����。
??按照注冊品種區(qū)分����,醫(yī)療器械9695項,占全部醫(yī)療器械注冊數(shù)量的73.8%���;體外診斷試劑3438項�,占全部醫(yī)療器械注冊數(shù)量的26.2%��。
??按照注冊形式區(qū)分����,首次注冊3363項,占全部醫(yī)療器械注冊數(shù)量的26%����;延續(xù)注冊4722項,占全部醫(yī)療器械注冊數(shù)量的36%����;變更注冊5048項�����,占全部醫(yī)療器械注冊數(shù)量的38%。注冊形式比例情況見圖6�����。
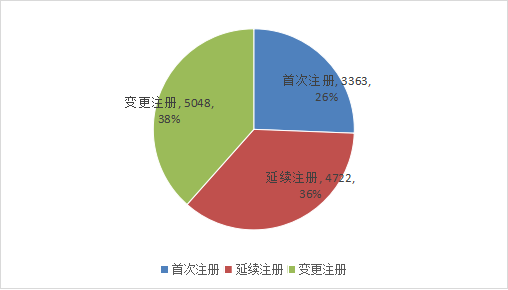
圖6? 國家藥監(jiān)局2024年注冊形式比例圖
??(二)分項情況
??1.境內(nèi)第三類醫(yī)療器械注冊審批情況
??境內(nèi)第三類醫(yī)療器械注冊6886項�����。其中��,醫(yī)療器械5272項�,體外診斷試劑1614項。
??從注冊形式看��,首次注冊2655項�����,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的38.6%����,延續(xù)注冊1969項�����,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的28.6%����;變更注冊2262項���,占全部境內(nèi)第三類醫(yī)療器械注冊數(shù)量的32.8%����。注冊形式分布情況見圖7�����。

圖7 境內(nèi)第三類醫(yī)療器械注冊形式分布圖
??2.進口第二類醫(yī)療器械注冊審批情況
??進口第二類醫(yī)療器械3228項����。其中,醫(yī)療器械注冊1745項��,體外診斷試劑注冊1483項���。
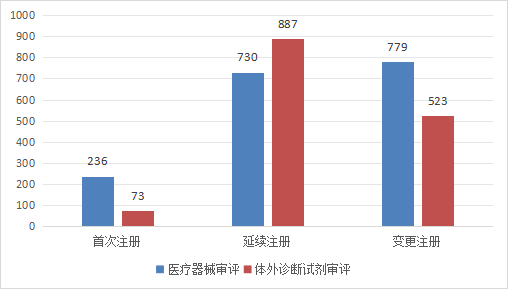
圖8 進口第二類醫(yī)療器械注冊形式分布圖
??從注冊形式看���,首次注冊309項���,占全部進口第二類醫(yī)療器械注冊數(shù)量的9.6%;延續(xù)注冊1617項����,占全部進口第二類醫(yī)療器械注冊數(shù)量的50.1%��;變更注冊1302項�,占全部進口第二類醫(yī)療器械注冊數(shù)量的40.3%。注冊形式分布情況見圖8����。
??3.進口第三類醫(yī)療器械注冊審批情況
??進口第三類醫(yī)療器械注冊3019項。其中�,醫(yī)療器械注冊2678項,體外診斷試劑注冊341項�。

圖9 進口第三類醫(yī)療器械注冊形式分布圖
??從注冊形式看,首次注冊399項�,占全部進口第三類醫(yī)療器械注冊數(shù)量的13.2%;延續(xù)注冊1136項���,占全部進口第三類醫(yī)療器械注冊數(shù)量的37.6%��;變更注冊1484項�,占全部進口第三類醫(yī)療器械注冊數(shù)量的49.2%。注冊形式分布情況見圖9�����。
??(三)首次注冊項目月度審批情況
??2024年���,國家藥監(jiān)局首次注冊月度審批情況見圖10���。
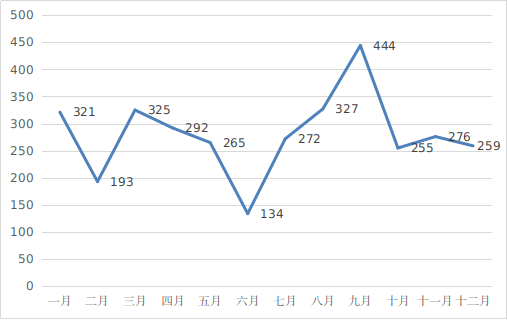
圖10 首次注冊項目月度審批圖
??(四)具體批準品種種類分析
??注冊的境內(nèi)第三類醫(yī)療器械,除體外診斷試劑外����,共涉及《醫(yī)療器械分類目錄》中18個子目錄的產(chǎn)品。
??注冊數(shù)量前五位的境內(nèi)第三類醫(yī)療器械是:無源植入器械���,神經(jīng)和心血管手術(shù)器械��,有源手術(shù)器械���,注輸����、護理和防護器械����,口腔科器械。與2023年相比���,有源手術(shù)器械超過注輸�����、護理和防護器械,注冊數(shù)量同比增加61.5%���,口腔科器械超過醫(yī)用成像器械進入前五位����,其他品類注冊數(shù)量也有所增加��,如注輸��、護理和防護器械增加17%�,神經(jīng)和心血管手術(shù)器械增加8.4%�,無源植入器械增加2.3%�。
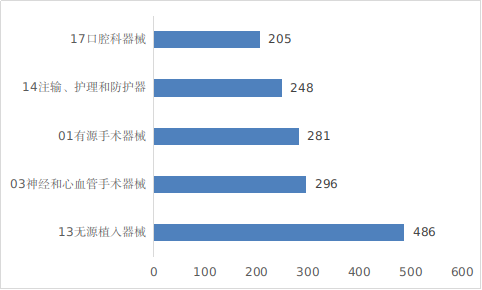
圖11 境內(nèi)第三類醫(yī)療器械注冊品種排位圖
??注冊的進口醫(yī)療器械,除體外診斷試劑外��,共涉及《醫(yī)療器械分類目錄》中21個子目錄的產(chǎn)品��。
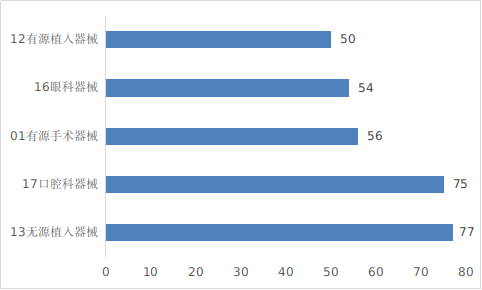
圖12 進口醫(yī)療器械注冊品種排位圖
??注冊數(shù)量前五位的進口醫(yī)療器械����,主要是:無源植入器械,口腔科器械��,有源手術(shù)器械�����,眼科器械�����,有源植入器械���,與2023年相比��,變化較大�����,有源植入器械超過醫(yī)用成像器械進入前五位�����,有源手術(shù)器械超過眼科器械�����,注冊數(shù)量同比增加24.4%���,其他品類注冊數(shù)量略有增加����。
??(五)進口醫(yī)療器械國別情況
??2024年��,共有33個國家(地區(qū))產(chǎn)品在我國獲批上市��。
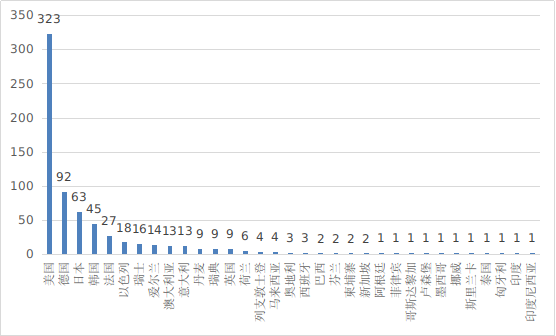
圖13 進口醫(yī)療器械注冊國別排位圖
??其中���,美國、德國、日本�、韓國、法國醫(yī)療器械在中國醫(yī)療器械進口產(chǎn)品首次注冊數(shù)量位列前5位�,注冊產(chǎn)品數(shù)量約占2024年進口產(chǎn)品首次注冊總數(shù)量的78%,與2023年相比略有增加�。
??從進口醫(yī)療器械代理人分布看,共有21個省涉及有本省企業(yè)作為進口醫(yī)療器械代理人�,其中上海市代理人代理的進口首次醫(yī)療器械數(shù)量最多,占全部進口醫(yī)療器械數(shù)量的65%���,與2023年相比略有增加����。
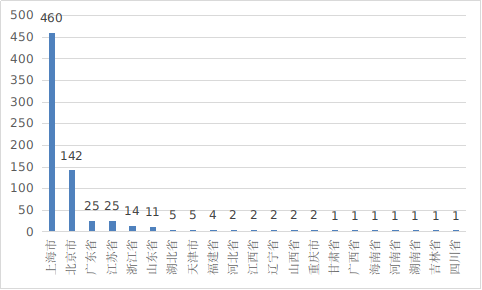
圖14 代理人代理的進口醫(yī)療器械數(shù)量省份排位圖
??(六)境內(nèi)第三類醫(yī)療器械省份分析
??從2024年境內(nèi)第三類醫(yī)療器械注冊情況看����,相關(guān)注冊人主要集中在沿海經(jīng)濟較發(fā)達省份。
??其中���,江蘇�、廣東�、北京、上海���、浙江是境內(nèi)第三類醫(yī)療器械首次注冊數(shù)量排前五名的省份�,占2024年境內(nèi)第三類醫(yī)療器械首次注冊數(shù)量的68%,與2023年相比基本持平��。

圖15 境內(nèi)第三類醫(yī)療器械注冊省份排位圖
??四���、創(chuàng)新醫(yī)療器械等產(chǎn)品注冊審批情況
??2024年�,國家藥監(jiān)局按照《創(chuàng)新醫(yī)療器械特別審查程序》《醫(yī)療器械優(yōu)先審批程序》繼續(xù)做好相關(guān)產(chǎn)品的審查工作�,共收到創(chuàng)新醫(yī)療器械特別審批申請451項,比2023年減少3.2%���。
??從2014年至2024年�����,國家藥監(jiān)局共批準315個創(chuàng)新醫(yī)療器械�。其中境內(nèi)創(chuàng)新醫(yī)療器械272個���,涉及16個省的193家企業(yè)����;進口創(chuàng)新醫(yī)療器械43個��,涉及6個國家的24個企業(yè)���。北京��、上海���、廣東、江蘇����、浙江創(chuàng)新醫(yī)療器械獲批產(chǎn)品數(shù)量和相應企業(yè)數(shù)量最多,約占全部已批準的315個創(chuàng)新醫(yī)療器械的75.9%����,與2023年相比有所下降。
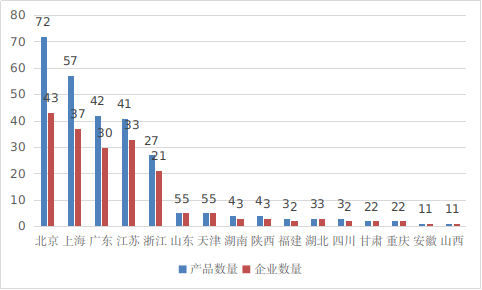
圖16 境內(nèi)創(chuàng)新醫(yī)療器械注冊省份排位圖
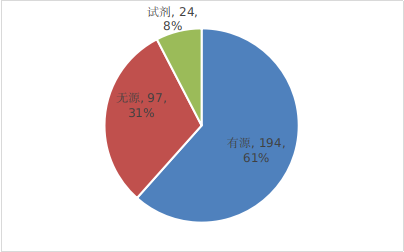
??已批準的創(chuàng)新醫(yī)療器械中�����,有源產(chǎn)品占比約61%�,無源產(chǎn)品約31%,體外診斷試劑產(chǎn)品約8%����,具體見下圖��。
??2024年��,國家藥監(jiān)局共批準65個創(chuàng)新醫(yī)療器械產(chǎn)品上市���,相比2023年增加6.6%。其中有源醫(yī)療器械45個�,無源醫(yī)療器械17個,體外診斷試劑3個��。
??有源手術(shù)器械���、無源植入器械�、有源植入器械����、醫(yī)用軟件、神經(jīng)和血管手術(shù)器械以及醫(yī)用成像器械等高端醫(yī)療器械是2024年批準的創(chuàng)新醫(yī)療器械數(shù)量前五位的品類���,與2023年相比���,神經(jīng)和血管手術(shù)器械、有源植入器械增加較快�。具體見圖17���。
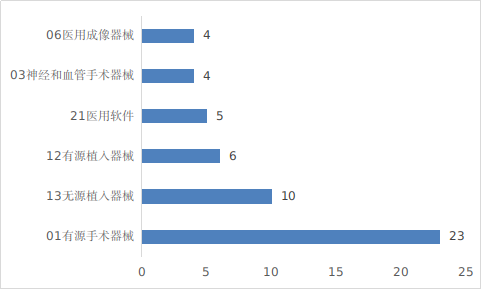
圖17 創(chuàng)新醫(yī)療器械注冊品種排位圖
??這些創(chuàng)新產(chǎn)品核心技術(shù)都有我國的發(fā)明專利權(quán)或者發(fā)明專利申請已經(jīng)國務院專利行政部門公開�����,產(chǎn)品主要工作原理/作用機理為國內(nèi)首創(chuàng)����,具有顯著的臨床應用價值。以下是已批準創(chuàng)新醫(yī)療器械產(chǎn)品介紹:
??(一)胃轉(zhuǎn)流支架系統(tǒng):該產(chǎn)品由輸送系統(tǒng)和回收系統(tǒng)組成��。輸送系統(tǒng)由輸送器��、胃轉(zhuǎn)流支架和導絲組成�,胃轉(zhuǎn)流支架預裝在輸送器的收納管中?��;厥障到y(tǒng)由回收管�����、回收鉤和回收帽組成��。該產(chǎn)品隔離食糜與腸道的接觸����,在轉(zhuǎn)流期間作為一種輔助生活方式管理體重的產(chǎn)品,用于生活方式調(diào)整無效����、無創(chuàng)治療及藥物治療效果不佳的相關(guān)肥胖癥患者。該產(chǎn)品在胃鏡輔助下置入十二指腸及空腸上段���,在不改動胃腸道生理結(jié)構(gòu)的基礎(chǔ)上達到類似胃旁路手術(shù)的效果�,減少十二指腸和空腸大部分組織對食物中營養(yǎng)成分的吸收���,達到減重目的��,為肥胖癥治療提供新的選擇�����。
??(二)IFI44L基因甲基化檢測試劑盒(PCR-熔解曲線法):該產(chǎn)品采用PCR熔解曲線法��,對人體全血樣本中IFI44L(干擾素誘導蛋白44L)基因啟動子區(qū)域DNA甲基化水平定性檢測�,聯(lián)合其他指標���,可用于系統(tǒng)性紅斑狼瘡的輔助診斷����。該產(chǎn)品由我國自主研發(fā)并擁有自主知識產(chǎn)權(quán),可在系統(tǒng)性紅斑狼瘡患者出現(xiàn)重要器官受累前進行診斷���,對于系統(tǒng)性紅斑狼瘡防治、改善患者的生活質(zhì)量��、提高患者生存率具有重要意義�����。
??(三)顱內(nèi)動脈瘤CT造影圖像輔助檢測軟件:該產(chǎn)品由軟件安裝程序組成��,包括瀏覽器端和服務器端�,用于頭頸動脈CT血管造影圖像的顯示、處理���、測量和分析��,對顱內(nèi)3mm及以上動脈瘤進行輔助檢測���。該產(chǎn)品采用頭頸血管中心線提取和血管分割技術(shù),大大提高了顱內(nèi)動脈瘤檢出的敏感性,對于改善患者生活質(zhì)量�����、提高患者生存率具有重要意義����。
??(四)一次性使用心臟脈沖電場消融導管:該產(chǎn)品由導管和連接電纜組成,與該公司生產(chǎn)的心臟脈沖電場消融儀配合使用�����,通過控制��、釋放適當強度的脈沖電場能量�����,有選擇性地僅對需要治療病灶部位的心肌細胞產(chǎn)生不可逆的電穿孔損傷�����,從而達到治療房顫的目的�����。該產(chǎn)品為藥物難治性、復發(fā)性��、癥狀性�����、陣發(fā)性房顫的治療提供了更多選擇�。
??(五)支氣管導航操作控制系統(tǒng)、支氣管導航光纖定位導管�、支氣管導航可視化探頭、支氣管導航光纖定位導管導引器�、支氣管導航操作控制系統(tǒng)用無源器械和附件和支氣管導航操作控制系統(tǒng)用針:上述產(chǎn)品配合使用�����,采用形狀感知光纖技術(shù)進行支氣管導航定位��。與已上市同類產(chǎn)品相比��,該產(chǎn)品光纖定位導管外徑更小��,可進入到更深的肺部氣道�,同時產(chǎn)品技術(shù)穩(wěn)定、精準����,不易受到干擾���,可有效降低氣胸和出血的并發(fā)癥率,對于提高患者生存率具有重要意義�。
??(六)組合血糖儀:該產(chǎn)品由有創(chuàng)血糖檢測模塊、無創(chuàng)血糖檢測模塊���、代謝熱探頭����、環(huán)境溫濕度監(jiān)測模塊和顯示屏組成���,作為現(xiàn)有指尖血糖監(jiān)測的補充�,適用于2型糖尿病患者日常自我血糖監(jiān)測����。該產(chǎn)品通過無創(chuàng)檢測代謝熱水平估算血糖濃度,屬國內(nèi)首創(chuàng)����。糖尿病患者可通過測量口腔深部體溫動態(tài)特征達到血糖測量的目的,有助于減少患者痛苦�、減輕測量成本�����。
??(七)寡糖鏈檢測試劑盒(熒光毛細管電泳法):該產(chǎn)品系我國自主研發(fā)����,采用毛細管電泳法對人體血清樣本中的9個寡糖鏈進行定性檢測��,用于臨床上乙肝肝硬化患者原發(fā)性肝細胞癌的輔助診斷���。該產(chǎn)品通過非侵入性檢測方法輔助診斷��,有助于原發(fā)性肝細胞癌防治�����。
??(八)體外心室輔助設備和體外心室輔助泵頭及管路:體外心室輔助設備由磁懸浮馬達、控制主機和配件組成�����,體外心室輔助泵頭及管路由離心泵泵頭�����、側(cè)孔直通接頭、魯爾帽�、管道夾和扎帶組成。兩產(chǎn)品聯(lián)合使用�����,與血管相連形成旁回支路�����,通過控制主機和磁懸浮馬達驅(qū)動泵頭內(nèi)葉輪懸浮轉(zhuǎn)動�,為血液增壓提供動能,用于心臟術(shù)后患者臨時體外機械循環(huán)輔助��。該產(chǎn)品采用全磁懸浮血泵技術(shù)���,具有抗振動�����、抗扭擺性能以及較好的血液流場設計�����,可有效降低血液相容性相關(guān)并發(fā)癥的平均發(fā)生率�����。
??(九)一次性使用多極腎動脈射頻消融導管和腎動脈射頻消融儀:一次性使用多極腎動脈射頻消融導管由電極陣列�、導管、導管手柄�����、導管連接電纜和矯直工具組成����,腎動脈射頻消融儀由發(fā)生器、遙控器��、電源線和DVI-D電纜組成��。上述兩產(chǎn)品配套使用���,射頻消融儀可將射頻能量經(jīng)過導管電極傳遞至腎動脈血管內(nèi)膜,利用電流熱效應使腎動脈血管周圍交感神經(jīng)失活�,阻斷交感神經(jīng)的興奮傳導,達到降低患者血壓的目的����。該產(chǎn)品通過物理方式阻斷交感神經(jīng)興奮傳導來降低血壓���,與傳統(tǒng)藥物治療方式相比,可有效避免患者依從性��、藥物半衰期等因素影響�,為難治性高血壓患者提供了新的輔助治療方式。
??(十)植入式腦深部電刺激電極導線套件�����、雙通道可充電植入式腦深部電刺激脈沖發(fā)生器套件�、雙通道植入式腦深部電刺激脈沖發(fā)生器套件和植入式腦深部電刺激延伸導線套件:上述產(chǎn)品是國產(chǎn)首個方向性腦深部電刺激產(chǎn)品,通過配套使用�,可對丘腦底核或內(nèi)側(cè)蒼白球進行刺激,用于對藥物不能有效控制某些癥狀的晚期左旋多巴反應性帕金森病患者進行聯(lián)合治療���。與傳統(tǒng)電極相比��,上述產(chǎn)品可為目標核團的特定功能亞區(qū)提供方向性刺激����,同時在電極輕微植偏的情況下可避免腦深部刺激的副作用����,減少再次手術(shù)植入電極的風險�。
??(十一)肺動脈取栓支架系統(tǒng):肺動脈取栓支架系統(tǒng)由肺動脈取栓裝置和血栓抽吸導管兩部分組成��。肺動脈取栓裝置由輸送鞘管和連有自膨式網(wǎng)籃結(jié)構(gòu)的推送管同軸組裝而成����;血栓抽吸導管由抽吸導管、導管芯和抽吸器組成����。用于有下述情況之一的急性高危肺栓塞或伴臨床惡化的中危肺栓塞的經(jīng)導管血栓清除治療:有肺動脈主干或主要分支血栓,并存在高出血風險或溶栓禁忌的患者��;有肺動脈主干或主要分支血栓����,并經(jīng)溶栓或積極的內(nèi)科治療無效的患者。該產(chǎn)品是國內(nèi)首創(chuàng)介入治療的肺動脈取栓支架系統(tǒng)����。該產(chǎn)品采用機械取栓的方式,減少了溶栓藥物的使用���,也為具有溶栓禁忌癥的患者提供了治療選擇。
??(十二)經(jīng)頸靜脈肝內(nèi)穿刺器械:經(jīng)頸靜脈肝內(nèi)穿刺器械由通芯針����、穿刺套管���、導向器、導引內(nèi)管�����、外鞘管��、長擴張器���、短擴張器組成��。產(chǎn)品經(jīng)環(huán)氧乙烷滅菌���,一次性使用。用于經(jīng)頸靜脈肝內(nèi)門靜脈穿刺����,進行門靜脈的肝內(nèi)分流手術(shù),以降低門靜脈壓�����。該產(chǎn)品首創(chuàng)金屬一體柔性針,易穿刺難變形��;變徑技術(shù)的首次應用����,進一步提高產(chǎn)品整體的穿刺性能并減小穿刺創(chuàng)傷;親水涂層技術(shù)在經(jīng)頸靜脈穿刺器械上的首次應用�,降低推送阻力、提高產(chǎn)品推送性能��。該產(chǎn)品提升手術(shù)效率��,一定程度上減少并發(fā)癥���,提高安全性����。?
??(十三)一次性使用射頻房間隔穿刺針:一次性使用射頻房間隔穿刺針由帶射頻穿刺電極頭的導管和控制手柄連接組成�����,經(jīng)股靜脈入路與該公司生產(chǎn)的射頻發(fā)生器及可調(diào)彎導管鞘配套使用�,用于計劃接受經(jīng)房間隔穿刺路徑進行心內(nèi)科介入治療的患者�����,通過從右心房行房間隔穿刺至左心房并建立二者之間的通路,輔助后續(xù)的介入治療器械順利進入左心房����。該產(chǎn)品與傳統(tǒng)機械性房間隔穿刺產(chǎn)品相比,采用射頻能量穿刺�,所需施加機械力更少,穿刺過程更加可控���;遠端采用可彎曲柔性材質(zhì)��,配合其他可調(diào)式器械使用�,可精確調(diào)整角度到達目標組織��,避免對非目標組織造成傷害�;流體通道出口更接近電極頭,穿刺更精準��、安全�����;手柄具備能量控制開關(guān),較腳踏開關(guān)反應時間更短�,提升房間隔穿刺手術(shù)的成功率和安全性。
??(十四)眼底病變眼底圖像輔助診斷軟件:眼底病變眼底圖像輔助診斷軟件包含客戶端和服務器端��,其中服務器端軟件包括用戶注冊與登錄模塊���、患者信息管理模塊���、基于深度學習算法的圖像自動分析模塊(包含圖像質(zhì)量判定模塊和眼底多病種識別模塊)、報告生成和管理模塊和系統(tǒng)管理模塊����。該產(chǎn)品為首個基于多病種算法設計的眼底圖像輔助診斷軟件。與單病種算法相比��,該產(chǎn)品采用單一網(wǎng)絡模型即可判斷是否存在眼底異常�,進而對多種常見眼底疾病進行識別。該產(chǎn)品可以輔助醫(yī)生實施多種眼底疾病綜合檢查�����,與單病種輔助診斷產(chǎn)品相比����,其適用范圍更廣�����,可進一步提升基層醫(yī)療機構(gòu)常見眼底病診斷能力�����,促使更廣泛人群能夠接受早期檢查和診療,減少視力損傷和致盲性疾病的發(fā)生����,降低相關(guān)疾病帶來的社會負擔。
??(十五)冷凍消融儀:該產(chǎn)品由主機�、氣體延長管和球囊導管尾線組成,與特定球囊型冷凍消融導管聯(lián)合使用�����,用于成人患者藥物難治性����、復發(fā)性、癥狀性的陣發(fā)性房顫治療��。相較于在我國已上市的國內(nèi)��、外同類產(chǎn)品,該產(chǎn)品使用的“冷量可調(diào)”和“復溫提醒”技術(shù)具有首創(chuàng)性���?��!袄淞靠烧{(diào)”技術(shù)可實時監(jiān)測冷凍溫度,在保證冷凍消融治療效果的基礎(chǔ)上減少對臨近組織的損傷��?��!皬蜏靥嵝选奔夹g(shù)可以降低提前回縮球囊產(chǎn)生的患者心肌損傷�、球囊入鞘困難等臨床和操作風險��。
??(十六)一次性使用心臟脈沖電場消融導管和心臟脈沖電場消融系統(tǒng):一次性使用心臟脈沖電場消融導管由心臟脈沖電場消融導管和導管連接電纜組成�����,心臟脈沖電場消融系統(tǒng)由脈沖電場消融儀���、記錄模塊及附件電纜組成����。上述兩個產(chǎn)品配合使用�����,用于患者藥物難治性、復發(fā)性����、癥狀性的陣發(fā)性房顫治療。該產(chǎn)品利用脈沖電場的非熱效應原理進行房顫治療�,可實現(xiàn)對心肌組織的選擇性破壞,避免溫度傳遞導致的周圍組織損傷風險�����。
??(十七)髂靜脈支架系統(tǒng):該產(chǎn)品由支架和輸送器組成�����,支架預裝在輸送器內(nèi)���,支架為自膨式鎳鈦合金支架,顯影點材料為鉭����,輸送器由鞘芯、鞘管接頭����、止血閥���、手柄和尾柄組成。產(chǎn)品經(jīng)環(huán)氧乙烷滅菌�,一次性使用。該產(chǎn)品預期在髂總靜脈內(nèi)使用�����,用于治療非血栓性髂靜脈壓迫綜合征��。該產(chǎn)品通過靜脈支架近端斜口�����、喇叭口設計���,中段開環(huán)設計���,支架分段式設計,提高產(chǎn)品性能���,以滿足臨床需求�����。
??(十八)便攜式超聲診斷儀和一次性使用心腔內(nèi)超聲成像導管:便攜式超聲診斷儀由超聲主機���、連接器和電源適配器組成�����。一次性使用心腔內(nèi)超聲成像導管由導管頭端��、可調(diào)彎管��、操作手柄和尾部連接器組成�,利用逆壓電效應將便攜式超聲診斷儀輸出的脈沖電信號轉(zhuǎn)變?yōu)槌暡òl(fā)射至心臟腔內(nèi)組織��,并接收回波信號傳遞至便攜式超聲診斷儀���,轉(zhuǎn)為數(shù)字圖像信號后在顯示器上呈現(xiàn)。上述兩個產(chǎn)品配合使用���,用于對成人心臟及心臟大血管�、心內(nèi)解剖結(jié)構(gòu)進行超聲成像���,與同類產(chǎn)品相比����,具有更大探測深度,且為國內(nèi)首個心腔內(nèi)超聲成像系統(tǒng)�。
??(十九)生物可吸收雷帕霉素洗脫冠脈支架系統(tǒng):該產(chǎn)品由藥物支架和輸送系統(tǒng)組成。支架由支架基體����、顯影標記、藥物涂層三部分構(gòu)成����,支架基體材料為左旋聚乳酸(PLLA),在支架近遠端各有一個顯影標記物����,雷帕霉素藥物涂層噴涂于支架外表面單面。輸送系統(tǒng)為快速交換式球囊擴張導管��。該產(chǎn)品經(jīng)輻照滅菌�,一次性使用,改善冠狀動脈腔內(nèi)直徑�,適用于冠脈原發(fā)病變導致的缺血性心臟病患者。該產(chǎn)品采用了單面藥物涂層技術(shù),通過點涂工藝僅在支架外表面涂敷藥物����,支架桿側(cè)面及內(nèi)表面無藥物涂層,提高了藥物利用率�����,有利于血管內(nèi)皮化進程�����。
??(二十)腎動脈射頻消融儀和一次性使用腎動脈射頻消融導管:腎動脈射頻消融儀由主機�����、腳踏開關(guān)�、手控器、中性電極電纜�����、等電位均衡導線和電源線組成���。一次性使用腎動脈射頻消融導管由消融導管和連接電纜組成。腎動脈射頻消融儀通過單通道輸出射頻能量,經(jīng)過導管電極傳遞至腎動脈血管內(nèi)膜�����,利用電流熱效應使腎動脈血管周圍交感神經(jīng)失活��,阻斷交感神經(jīng)興奮傳導��。同時����,導管電極可輸出電刺激信號對腎動脈進行標測,通過血壓變化識別交感神經(jīng)��,實現(xiàn)選擇性消融���。該產(chǎn)品適用于難治性高血壓和藥物不耐受高血壓輔助治療中�����,對藥物使用有減量需求的高血壓患者��。該產(chǎn)品為全球首款可標測腎神經(jīng)的腎動脈射頻消融類產(chǎn)品�����,能夠為腎交感神經(jīng)去除術(shù)提供準確消融位置����,還可在術(shù)中、術(shù)后提供有效反饋�,以評判腎交感神經(jīng)去除術(shù)的即時效果,滿足去腎神經(jīng)術(shù)在臨床實踐中的需要����。
??(二十一)腎動脈射頻消融儀及一次性使用網(wǎng)狀腎動脈射頻消融導管:腎動脈射頻消融儀由主機、腳踏開關(guān)����、主機連接線、中性電極連接線以及電源線組成�。一次性使用網(wǎng)狀腎動脈射頻消融導管由網(wǎng)籃支架、消融電極���、保護鞘����、手柄��、接插件組成���。上述兩個產(chǎn)品配套使用����,用于輔助治療難治性高血壓及藥物不耐受的高血壓患者��。一次性使用網(wǎng)狀腎動脈射頻消融導管具有螺旋式排布的六個電極���,能夠有效提高消融效率�����,網(wǎng)籃狀設計使消融時血流不被阻斷����,在國內(nèi)及國際上均屬獨創(chuàng)����。腎動脈射頻消融儀采用的溫度、阻抗測量及反饋控制算法�����,使手術(shù)操作更加簡便��。該產(chǎn)品上市有利于射頻消融技術(shù)的臨床應用推廣,可進一步降低臨床治療費用��,使更多難治性高血壓及藥物不耐受的高血壓患者受益�����。
??(二十二)球囊型冷凍消融導管:該產(chǎn)品由球囊型冷凍消融導管���、手動回縮器組成��,與特定冷凍消融儀聯(lián)合使用���,用于治療成人患者藥物難治性、復發(fā)性�、癥狀性的陣發(fā)性房顫。該產(chǎn)品所用“32mm大球囊”和“8mm短頭”設計����,可以穩(wěn)定控制制冷劑流量,有效控制冷凍溫度�,且可貼近肺靜脈口,有效采集肺靜脈電位���,從而保證冷凍消融效果�。相較于在中國上市的國內(nèi)、國外同類產(chǎn)品��,該技術(shù)具有首創(chuàng)性�。該產(chǎn)品上市可進一步滿足我國在陣發(fā)性房顫治療領(lǐng)域的臨床需求����。
??(二十三)經(jīng)導管主動脈瓣膜系統(tǒng):該產(chǎn)品由經(jīng)導管主動脈瓣膜、經(jīng)導管主動脈瓣膜輸送系統(tǒng)(包括輸送器和瓣膜載入器)�����、主動脈瓣球囊擴張導管����、壓握裝置及球囊充壓裝置組成。經(jīng)導管主動脈瓣膜系統(tǒng)是國產(chǎn)首款球囊擴張式經(jīng)導管主動脈瓣膜產(chǎn)品���,適用于經(jīng)心臟團隊結(jié)合評分系統(tǒng)評估后認為患有有癥狀的�����、鈣化的��、重度退行性自體主動脈瓣狹窄����,不適合接受常規(guī)外科手術(shù)置換瓣膜、年齡大于等于70歲的患者����。在醫(yī)學影像設備監(jiān)護下,該產(chǎn)品通過股動脈經(jīng)導管植入到人體主動脈瓣環(huán)處��,代替原有的病變主動脈瓣膜�,改善病變部位狹窄,改善心功能���。? ??
??(二十四)靜脈支架系統(tǒng):該產(chǎn)品由靜脈支架及輸送系統(tǒng)組成���,預期在髂股靜脈內(nèi)使用,用于治療非血栓性髂靜脈壓迫綜合征����、深靜脈血栓形成及深靜脈血栓形成后綜合征。其中����,支架采用一體化編織方法,具有不同網(wǎng)孔密度,疏密網(wǎng)孔相結(jié)合的設計可有效滿足臨床上對支架的支撐力和柔順性需求��。
??(二十五)經(jīng)導管主動脈瓣系統(tǒng):該產(chǎn)品由生物瓣膜��、輸送器�、球囊擴張導管、導管鞘套件��、壓握器����、充壓泵組成��。采用球囊擴張式瓣架結(jié)構(gòu)��,適用于經(jīng)心臟團隊結(jié)合評分系統(tǒng)評估后認為患有有癥狀的����、鈣化的、重度退行性自體主動脈瓣狹窄��,不適合接受常規(guī)外科手術(shù)置換瓣膜�、年齡大于等于70歲的患者。在醫(yī)學影像設備監(jiān)護下���,可選擇性通過長��、短兩款輸送系統(tǒng)經(jīng)由不同入路將生物瓣膜植入到人體主動脈瓣環(huán)處�����,代替原有的病變主動脈瓣膜����,改善病變部位狹窄,改善心功能����,滿足不同入路患者臨床需求。
??(二十六)血管斑塊旋切控制裝置和一次性使用外周血管斑塊旋切導管:血管斑塊旋切控制裝置由主機和電源線組成�。一次性使用外周血管斑塊旋切導管由電動導管、空間分離艙和可拆卸激活手柄組成�。上述兩個產(chǎn)品配套使用,用于股腘動脈原發(fā)性病變的經(jīng)皮腔內(nèi)斑塊旋切預處理治療�。與傳統(tǒng)斑塊切除器械相比,該產(chǎn)品采用旋切結(jié)合主動抽吸的創(chuàng)新設計���,實現(xiàn)了斑塊切除及主動抽吸-灌注功能��,在提供更有效的斑塊切除療效的同時��,將斑塊顆粒通過抽吸系統(tǒng)排出體外�����,減少遠端栓塞等不良事件的發(fā)生��。
??(二十七)乙型肝炎病毒表面抗原(HBsAg)檢測試劑盒:乙型肝炎病毒表面抗原(HBsAg)檢測試劑盒由抗體結(jié)合粒子����、酶標記抗體、樣本處理液組成�����,用于體外定性和定量檢測人血清或血漿中的乙型肝炎病毒表面抗原(HBsAg)��。與已上市同類產(chǎn)品相比�,該產(chǎn)品具有較高靈敏度��,能夠在乙型肝炎病毒感染者感染初期�����,體內(nèi)血液中乙肝病毒表面抗原濃度較低時檢測出相應抗原�,實現(xiàn)早診斷、早治療。
??(二十八)導航定位微波消融系統(tǒng):導航定位微波消融系統(tǒng)由主控臺車(含機械臂��、腳踏開關(guān))�、微波治療臺車(含光學跟蹤模塊、腳踏開關(guān))�、導航定位工具、微波傳輸線��、一次性使用微波消融針及一次性使用測溫針組成�。該產(chǎn)品可在術(shù)前基于CT圖像制定進針計劃,術(shù)中引導微波消融針進行經(jīng)皮穿刺手術(shù)���,用于成人肝臟實體腫瘤的微波消融����。與傳統(tǒng)微波消融設備相比����,該產(chǎn)品創(chuàng)新性地融合了導航定位技術(shù)、呼吸跟蹤技術(shù)和微波消融技術(shù)�,為國際首創(chuàng),有效提高臨床微波消融針置針���、病灶靶區(qū)消融的精準度以及消融手術(shù)效率和成功率����,降低對醫(yī)生穿刺、消融規(guī)劃經(jīng)驗的要求���,提高穿刺消融治療的有效性和安全性���。
??(二十九)心臟脈沖電場消融儀和一次性使用心臟脈沖電場消融導管:心臟脈沖電場消融儀由發(fā)生器、控制器(可選)�����、腳踏開關(guān)(可選)����、EGM線纜、一次性使用導管接口線纜組成�。一次性使用心臟脈沖電場消融導管由電極�����、管身和手柄組成����。上述兩個產(chǎn)品配套使用�����,利用脈沖電場的非熱效應原理����,治療藥物難治性��、復發(fā)性���、癥狀性陣發(fā)性房顫或藥物難治性���、復發(fā)性、癥狀性持續(xù)性房顫(發(fā)作持續(xù)時間小于1年)����。與傳統(tǒng)的射頻消融及冷凍消融產(chǎn)品相比,該產(chǎn)品可實現(xiàn)對心肌組織的選擇性破壞����,避免溫度傳遞導致的周圍組織損傷風險。
??(三十)顱內(nèi)動脈瘤CT血管造影圖像輔助檢測軟件:該產(chǎn)品由軟件安裝程序和授權(quán)文件組成��,功能模塊包括瀏覽器端�����、服務器端,用于頭頸動脈CT血管造影圖像的顯示���、處理����、測量和分析����,可對顱內(nèi)3mm及以上動脈瘤進行輔助檢測。該產(chǎn)品采用基于深度學習的頭頸血管分割分段技術(shù)和多尺度動脈瘤檢測技術(shù)��,有效提高了顱內(nèi)動脈瘤的診斷準確性和效率�����,對提升患者生存率具有重要意義�����。
??(三十一)膝關(guān)節(jié)假體系統(tǒng):該產(chǎn)品由股骨部件����、脛骨部件和髕骨部件組成,適用于骨骼發(fā)育成熟患者的初次膝關(guān)節(jié)置換術(shù)�。其中,股骨髁及脛骨托與骨結(jié)合界面均復合有采用增材制造工藝制作的骨小梁多孔結(jié)構(gòu)����,具有高摩擦系數(shù)和良好的骨結(jié)合性能。
??(三十二)顱內(nèi)動脈瘤栓塞輔助支架:該產(chǎn)品由支架����、輸送導絲和導入鞘三部分組成,其中支架部分由鎳鈦合金管材經(jīng)激光雕刻而成����,在支架兩端及部分型號中部有鉑銥顯影點,便于臨床精準判斷支架打開及貼壁情況�����。在臨床標準介入手術(shù)操作條件下�,根據(jù)血管造影術(shù)來確定顱內(nèi)動脈瘤位置,用于顱內(nèi)動脈瘤患者血管內(nèi)輔助栓塞和重建血流���。
??(三十三)腦外科手術(shù)計劃軟件:該產(chǎn)品由軟件安裝程序和授權(quán)文件組成����,功能模塊包括:用戶登錄、患者序列管理���、手術(shù)計劃����、圖像配準��、三維重建���、頭架參數(shù)計算�、纖維束生成���,用于制定腦外科手術(shù)計劃�����。該產(chǎn)品采用多維度空間血管重建和規(guī)避技術(shù)����,通過結(jié)合現(xiàn)有頭架工具和規(guī)劃路徑�����,可實現(xiàn)手術(shù)路徑的優(yōu)化�,提高臨床工作效率。該技術(shù)達到國際先進水平�,具有首創(chuàng)性。
??(三十四)植入式腦深部神經(jīng)刺激電極:該產(chǎn)品由電極與顱孔電極鎖蓋及補充工具包���、隧道工具���、扭矩扳手和連接電纜組成,通過傳導電刺激脈沖�,實現(xiàn)對雙側(cè)丘腦底核和蒼白球內(nèi)側(cè)部刺激,用于中晚期左旋多巴反應性帕金森病癥狀進行輔助治療��。該產(chǎn)品采用端頭電極��、方向性電極與多重獨立電流相結(jié)合的技術(shù)���,可有效增加腦深部電刺激術(shù)治療窗�����、提升靶點定位精度和治愈率���,減少再次手術(shù)植入電極的風險����。
??(三十五)氧化鋯陶瓷股骨頭:該產(chǎn)品為髖關(guān)節(jié)假體組件����,由氧化鋯陶瓷材料制成,與同企業(yè)同系列組件配合���,適用于髖關(guān)節(jié)置換����。該產(chǎn)品采用高低溫循環(huán)燒結(jié)技術(shù)��,降低了燒結(jié)的高溫溫度�,既為晶界擴散提供驅(qū)動力,又可避免高溫溫度過高引起的性能不佳問題����。與金屬股骨頭相比,氧化鋯陶瓷股骨頭的化學惰性可有效避免金屬離子釋放�,減少假體松動問題發(fā)生,同時還具有更好的生物相容性���。
??(三十六)植入式心臟起搏電極導線:該產(chǎn)品由電極導線及附件組成����,聯(lián)合配套的心臟起搏器構(gòu)成一個植入式心臟起搏系統(tǒng),主要用于心房和心室的起搏和感知���。該產(chǎn)品可有效降低MRI掃描時心肌組織的溫升,更好滿足心律失?��;颊吲R床1.5T磁共振成像檢查需求����。
??(三十七)超聲診斷系統(tǒng):該產(chǎn)品由主機����、探頭和選配件組成,在線陣探頭基礎(chǔ)上同步輸出近紅外激光��,使被測組織受熱膨脹產(chǎn)生特定頻率的超聲信號���,并將其強度和特征轉(zhuǎn)化為圖像顯示�,獲得被測區(qū)域組織中血氧分布情況���,用于臨床超聲和光聲診斷檢查�����。該產(chǎn)品為國內(nèi)首個融合超聲和光聲成像技術(shù)的雙模態(tài)成像產(chǎn)品���,可在一個成像周期內(nèi)��,同時顯示超聲組織結(jié)構(gòu)圖像和光聲圖像�,為醫(yī)生診斷患者病情提供更豐富的組織結(jié)構(gòu)和功能信息��。
??(三十八)陡脈沖治療設備和一次性使用陡脈沖消融針:陡脈沖治療設備由主機���、電動懸臂機構(gòu)�、腳踏開關(guān)組成�����,與一次性使用陡脈沖消融針及連接線組配套使用����。陡脈沖治療設備采用納秒高壓脈沖電場發(fā)生裝置,利用線性調(diào)制技術(shù)�,通過脈沖成形網(wǎng)絡存儲能量并形成脈沖�,具有電場強度高�、脈寬短的特性,屬于國內(nèi)首創(chuàng)�����。通過非熱消融技術(shù)��,使消融針經(jīng)皮穿刺作用于靶區(qū)�,產(chǎn)生高壓脈沖電場,使細胞產(chǎn)生不可逆的穿孔效應�、快速凋亡��,實現(xiàn)肝臟惡性實體腫瘤消融���。該技術(shù)屬于微創(chuàng)介入類腫瘤治療的新技術(shù)����,對于改善患者生活質(zhì)量�、提高患者生存率具有重要意義。
??(三十九)質(zhì)子治療系統(tǒng):該產(chǎn)品由加速器子系統(tǒng)和治療子系統(tǒng)組成��,其中加速器子系統(tǒng)包括離子源�、磁鐵單元���、射頻單元、真空單元�����、水冷單元���、束流引出單元����;治療子系統(tǒng)包括旋轉(zhuǎn)機架����、治療頭、圖像引導及配準系統(tǒng)��、治療控制臺�、放射治療計劃系統(tǒng)、激光定位系統(tǒng)等���。通過提供質(zhì)子束進行放射治療�,適用于全身實體惡性腫瘤及三叉神經(jīng)痛等良性疾病�。該產(chǎn)品是我國首臺小型化集成型單室質(zhì)子治療系統(tǒng)��,具有低成本���、小體積、快速掃描和高集成度等特性��。該產(chǎn)品采用適應性孔徑技術(shù)��,在提升影像清晰度的同時���,對凹凸以及島塊組織結(jié)構(gòu)的適應能力增強�����,可實現(xiàn)高精度和高適應性治療,使更多患者獲益����。
??(四十)心臟脈沖電場消融儀:心臟脈沖電場消融儀由主機、隔離電源�、腳踏開關(guān)和附件線纜組成,附件線纜包括:三維定位設備連接線�����、串行計算機接口電纜、阻抗監(jiān)控連接電纜��、接地電纜����。該產(chǎn)品與一次性使用脈沖電場消融導管配合使用,主要用于房顫治療���。該產(chǎn)品采用脈沖電場消融技術(shù)���,通過控制脈沖電場能量,對病灶部位組織進行選擇性治療�����,使心肌細胞產(chǎn)生不可逆的電穿孔損傷�,從而達到治療目的。該技術(shù)可有效降低周邊正常組織的熱損傷風險��,使更多藥物難治性���、復發(fā)性��、癥狀性�����、陣發(fā)性房顫的患者受益����。
??(四十一)人工血管:該產(chǎn)品用于動靜脈瘺的建立。產(chǎn)品結(jié)構(gòu)為三層復合型結(jié)構(gòu)����,可減少術(shù)中滲血,具有較好縫合強度�����,使用過程中不易變形或扭折�����,預期有助于改善植入后的通暢性��。
??(四十二)主動脈覆膜支架破膜系統(tǒng):該產(chǎn)品是體內(nèi)原位開窗技術(shù)的破膜工具�,與同公司已經(jīng)過驗證的主動脈弓主體支架系統(tǒng)配合使用�����,適用于治療需要重建左鎖骨下動脈血運的Stanford B型夾層患者,用于體內(nèi)支架原位開窗��。
??(四十三)腸息肉電子下消化道內(nèi)窺鏡圖像輔助檢測軟件:該產(chǎn)品采用U盤形式單機安裝使用���,由用戶模塊����、管理模塊�����、影像采集與顯示模塊�、區(qū)域采集控制模塊、自動標識模塊����、算法模塊和基礎(chǔ)模塊組成,主要用于成人結(jié)腸內(nèi)窺鏡檢查���。該產(chǎn)品采用雙流融合深度卷積神經(jīng)網(wǎng)絡算法���,可實現(xiàn)手術(shù)過程中的動態(tài)信息實時顯示,具有低延遲、高精度優(yōu)勢����,能夠為患者提供更高效高質(zhì)量的輔助檢測服務。
??(四十四)質(zhì)子治療系統(tǒng):該產(chǎn)品由加速器子系統(tǒng)和治療子系統(tǒng)組成�����,其中加速器子系統(tǒng)包括主加速器系統(tǒng)��、能量選擇系統(tǒng)和射束傳輸系統(tǒng)�,治療子系統(tǒng)(含4個治療室)包括360°旋轉(zhuǎn)束治療系統(tǒng)和治療計劃系統(tǒng)。該產(chǎn)品提供質(zhì)子束進行放射治療�����,適用于治療全身實體惡性腫瘤及某些良性疾病�����,具體適應證應由臨床醫(yī)師根據(jù)實際情況確定����。
??(四十五)旋磨介入治療儀和一次性使用冠脈旋磨導管:旋磨介入治療儀由主機和電源線組成,一次性使用冠脈旋磨導管由旋磨導管和旋磨推進器組成����,二者聯(lián)合使用,主要用于原發(fā)性冠狀動脈嚴重鈣化病變的預處理��。該產(chǎn)品屬于國內(nèi)首創(chuàng)�,采用變徑雙向旋磨技術(shù),利用偏心結(jié)構(gòu)的旋磨頭�����,通過調(diào)節(jié)旋轉(zhuǎn)速度改變離心力控制旋磨直徑��,減少術(shù)中器械切換���,實現(xiàn)降低介入創(chuàng)傷和提升管腔修飾效果的目的��,有效提高患者血管介入治療的成功率�����。
??(四十六)一次性使用磁電定位壓力監(jiān)測脈沖電場消融導管:該產(chǎn)品由頭端�����、管身��、手柄����、連接線纜和光電混合插頭組成,與上海宏桐實業(yè)有限公司的心臟脈沖電場消融儀配合使用��。該產(chǎn)品采用脈沖電場消融技術(shù)��,通過控制脈沖電場能量���,實現(xiàn)對病灶部位的心肌細胞選擇性治療�,使其產(chǎn)生不可逆的電穿孔損傷����,有效減少手術(shù)中無效消融或心肌穿孔,為藥物難治性�����、復發(fā)性��、癥狀性�����、陣發(fā)性房顫的治療提供更多選擇。
??五����、其他注冊管理情況
??(一)境內(nèi)第二類醫(yī)療器械注冊審批情況
??2024年���,各省級藥品監(jiān)管部門共批準境內(nèi)第二類醫(yī)療器械注冊35821項�,與2023年相比增加6.7%��。其中�����,首次注冊14098項��,與2023年相比增加1%����,占全部境內(nèi)第二類醫(yī)療器械注冊數(shù)量的39.4%;延續(xù)注冊10577項����,與2023年相比增加12.1%,占全部境內(nèi)第二類醫(yī)療器械注冊數(shù)量的29.5%�;變更注冊11146項�����,與2023年相比增加9.3%�����,占全部境內(nèi)第二類醫(yī)療器械注冊數(shù)量的31.1%�。
??2024年各省共注銷1423個注冊證��。境內(nèi)第二類醫(yī)療器械分項注冊情況見圖18����。
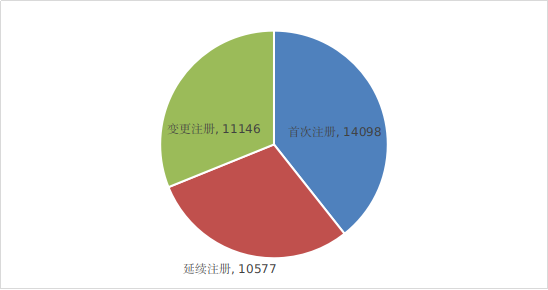
圖18 境內(nèi)第二類醫(yī)療器械注冊形式比例圖
??從注冊情況看,廣東����、江蘇、北京��、浙江��、河南���、湖南��、山東�、重慶、上海����、湖北10省(市)辦理境內(nèi)第二類醫(yī)療器械注冊事項較多�。
|
省份
|
首次注冊
|
延續(xù)注冊
|
變更注冊
|
總計
|
|
北京
|
656
|
1138
|
2096
|
3890
|
|
天津
|
313
|
275
|
422
|
1010
|
|
河北
|
456
|
373
|
358
|
1187
|
|
山西
|
240
|
84
|
64
|
388
|
|
內(nèi)蒙古
|
7
|
7
|
10
|
24
|
|
遼寧
|
113
|
107
|
118
|
338
|
|
吉林
|
516
|
237
|
163
|
916
|
|
黑龍江
|
109
|
49
|
15
|
173
|
|
上海
|
429
|
711
|
445
|
1585
|
|
江蘇
|
1926
|
1293
|
855
|
4074
|
|
浙江
|
973
|
1054
|
802
|
2829
|
|
安徽
|
238
|
145
|
194
|
577
|
|
福建
|
231
|
166
|
170
|
567
|
|
江西
|
269
|
136
|
372
|
777
|
|
山東
|
813
|
871
|
379
|
2063
|
|
河南
|
1042
|
694
|
868
|
2604
|
|
湖北
|
617
|
296
|
398
|
1311
|
|
湖南
|
1337
|
422
|
549
|
2308
|
|
廣東
|
1758
|
1542
|
1571
|
4871
|
|
廣西
|
463
|
156
|
213
|
832
|
|
海南
|
153
|
28
|
29
|
210
|
|
重慶
|
517
|
257
|
415
|
1189
|
|
四川
|
423
|
211
|
362
|
996
|
|
貴州
|
69
|
97
|
31
|
197
|
|
云南
|
94
|
44
|
54
|
192
|
|
西藏
|
8
|
0
|
0
|
8
|
|
陜西
|
220
|
87
|
133
|
440
|
|
甘肅
|
26
|
59
|
16
|
101
|
|
青海
|
27
|
4
|
14
|
45
|
|
寧夏
|
22
|
6
|
10
|
38
|
|
新疆
|
23
|
5
|
3
|
31
|
|
兵團
|
10
|
23
|
17
|
50
|
表1 境內(nèi)第二類醫(yī)療器械注冊表
????第二類醫(yī)療器械注冊具體數(shù)據(jù)見表1及圖19���。
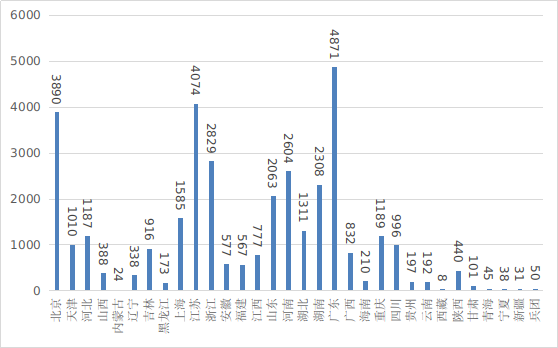
圖19 各省第二類醫(yī)療器械注冊數(shù)據(jù)圖
??從首次注冊情況看���,江蘇、廣東�、湖南、河南�����、浙江����、山東、北京��、湖北、重慶�、吉林10省(市)首次注冊的境內(nèi)第二類醫(yī)療器械數(shù)量較多����。各省第二類醫(yī)療器械首次注冊數(shù)量排位圖見圖20。
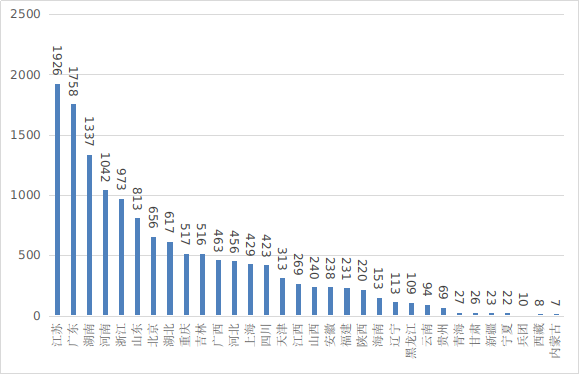
圖20 各省第二類醫(yī)療器械首次注冊數(shù)量排位圖
??(二)第一類醫(yī)療器械備案情況
??2024年��,國家藥監(jiān)局依職責共辦理進口第一類醫(yī)療器械備案數(shù)量2151項�,與2023年相比減少12.3%。
??2024年����,全國設區(qū)的市級藥品監(jiān)管部門依職責共辦理境內(nèi)第一類醫(yī)療器械備案數(shù)量22855項,與2023年相比減少11%����,已連續(xù)兩年減少。此外���,2024年各省取消第一類醫(yī)療器械備案13342項����。其中江蘇�、廣東�、浙江�����、山東��、河南是第一類備案數(shù)量前五的省份����。各省第一類醫(yī)療器械備案排位圖見圖21。
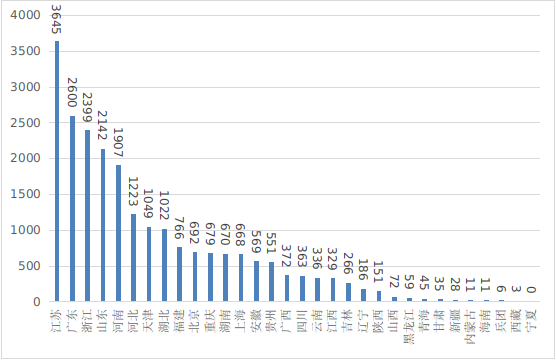
圖21 各省第一類醫(yī)療器械備案排位圖
??(三)登記事項變更/變更備案情況
??2024年�,國家藥監(jiān)局依職責共辦理進口第二���、三類和境內(nèi)第三類醫(yī)療器械變更備案9852項����,與2023年相比增加55.1%���。
??其中�,境內(nèi)第三類醫(yī)療器械變更備案7036項���,進口第二類����、三類醫(yī)療器械變更備案2816項。
??各省級藥品監(jiān)管部門依職責共辦理境內(nèi)第二類醫(yī)療器械變更備案19347項�,與2023年相比增加24.2%。
??(四)醫(yī)療器械臨床試驗機構(gòu)備案情況
??自2018年1月1日《醫(yī)療器械臨床試驗機構(gòu)條件和備案管理辦法》頒布實施以來����,全國共計1498個機構(gòu)完成了醫(yī)療器械臨床試驗機構(gòu)備案工作,2024年新增備案機構(gòu)158個�����,比2023年增加11.8%����。
??其中廣東、江蘇�、山東、浙江���、河南臨床試驗機構(gòu)備案數(shù)量居全國前五名�����。全國醫(yī)療器械臨床試驗機構(gòu)分布情況見圖22�。
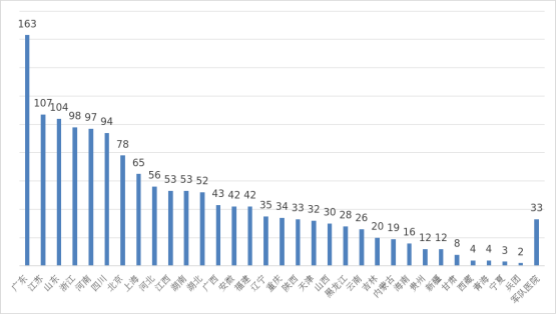
圖22? 全國醫(yī)療器械臨床試驗機構(gòu)備案數(shù)量
??注:本報告的數(shù)據(jù)統(tǒng)計自2024年1月1日至2024年12月31日。